Senin, 12 November 2012
Sabtu, 03 November 2012
PRAKTIKUM ELEKTROLISIS
A. TUJUAN :
Mengamati reaksi yang terjadi di anode dan katode pada reaksi elektrolisis.
B. DASAR TEORI :
Sel elektrolisis adalah sel elektrokimia di mana terjadi bentuk perubahan energy listrik menjadi energy kimia.
Dalam
sel ini, pada saat arus listrik dialirkan ke dalam larutan elektrolit,
akan terjadi pemisahan ion – ion dalam larutan, di mana ion – ion
positif (kation) akan mendekati elektroda negative (katoda) dan ion –
ion negative (anion) akan mendekati elektroda positif (anoda).
Pada
katoda akan terjadi reaksi reduksi ion atau air dan pada anoda akan
terjadi oksidasi anion atau air, atau logam elektroda, bergantung pada
jenis elektrolit serta anoda yang digunakan.
Sel
elektrolisis merupakan kebalikan dari sel volta. Dalam sel
elektrolisis, listrik digunakan untuk melangsungkan reaksi redoks tak
spontan. Sel elektrolisis terdiri dari sebuah electrode, elektrolit, dan
sumber arus searah. Electron memasuki sel elektrolisis melelui kutub
negatif (katoda). Spesi tertentu dalam larutan menyerap electron dari
katoda dan mengalami reduksi. Sedangkan spesi lain melepas electron di
anoda dan mengalami oksidasi.
Reaksi
elektrolisis terdiri dari reaksi katoda, yaitu reduksi, dan reaksi
anoda, yaitu oksidasi. Spesi yang terlibat dalam reaksi katoda dan anoda
bergantung pada potensial elektroda dari spesi tersebut. Ketentuannya
sebagai berikut.
- Spesi yang mengalami reduksi di katoda adalah spesi yang potensial reduksinya terbesar.
- Spesi yang mengalami oksidasi di anoda adalah spesi yang potensial oksidasinya terbesar.
Sel elektrolisis terbagi menjadi 2, yaitu:
- Elektrolisis larutan elektrolit.
- Elektrolisis larutan non elektrolit.
Elektroda dalam sel elektrolisis terbagi menjadi 2, yaitu:
- Elektroda inert/tidak aktif (elektroda karbon, platina, dan emas)
- Elektroda selain inert/aktif.
C. ALAT DAN BAHAN :
1. Pipa U.
2. Tabung reaksi.
3. Baterai 1,5 V sebanyak 3 buah.
4. kabel sebanyak 2 buah.
5. 2 elektrode karbon.
6. 2 penjepit buaya.
7. Pipet tetes.
8. Statif.
9. Kertas lakmus merah.
10. Kertas lakmus biru.
11. Larutan KI 0,5 M.
12. Larutan Na2SO4 0,5 M.
13. Larutan CuSO4 0,5 M.
14. Larutan amilum.
15. Indikator fenolftalein.
D. CARA KERJA :
1. Siapkan alat dan bahan.
2. Gunakan jas laboratorium dengan benar.
3. Cuci peralatan yang akan digunakan, seperti tabung reaksi, pipa U, pipet tetes, dan elektrode.
4. Lap dengan bersih dan biarkan hingga kering.
5. Rangkailah alat elektrolisis seperti gambar berikut :
 |
| rangkaian sel elektrolisis |
6. Masukkan larutan KI secukupnya dalam pipa U hingga elektrode bisa tercelup ke dalam larutan tersebut.
7. Hubungkan elektrode karbon dengan ujung kabel dengan penjepit buaya.
8. Masukkan elektrode pada bagian kanan dan kiri pipa U hingga tercelup larutan.
9. Lakukan elektrolisis dengan menghubungkan ujung kabel yang lain dengan baterai 4,5 V. Lakukan elektrolisis selama 10 menit.
10. Masukkan kertas lakmus merah dan biru ke dalam tabung reaksi yang masih kosong.
11. Ambil
larutan dari katode dengan menggunakan pipet tetes dan masukkan ke
dalam tabung reaksi yang telah diisi dengan kertas lakmus.
12. Ambil
beberapa tetes larutan di katode dan masukkan ke dalam tabung reaksi
yang masih kosong. Tetesi dengan indikator fenolftalein.
13. Kemudian
masukkan larutan amilum ke dalam tabung reaksi lainnya yang masih
kosong. Tetesi larutan amilum dengan larutan yang berasal dari anode.
14. Amati perubahan yang terjadi di masing-masing tabung reaksi.
15. Catatlah perubahan-perubahan yang terjadi.
16. Gantilah larutan KI dengan Na2SO4 dan CuSO4.
17. Ulangi langkah 6-15 dengan teliti dan cermat.
18. Setelah semuanya selesai, cuci kembali peralatan yang telah digunakan dan rapikan jas laboratorium.
E. DATA PENGAMATAN :
Berikut adalah data dari pengamatan elektrolisis yang dilakukan dengan menggunakan elektrode karbon:
JENIS LARUTAN
|
KATODE
|
ANODE
|
KI
|
Gelembung-gelembung gas
|
Endapan berwarna kuning
|
Na2SO4
|
Gelembung-gelembung gas (banyak)
|
Gelembung-gelembung gas (sedikit)
|
CuSO4
|
Endapan tembaga
|
Gelembung-gelembung gas
|
F. ANALISIS DATA
1. LARUTAN KI
Dalam
larutan KI dihasilkan gelembung-gelembung gas pada katode dan endapan
berwarna kuning pada anode. Reaksi yang terjadi adalah:
Di katode terjadi reaksi reduksi air karena ion K+ adalah ion dari logam golongan IA yang termasuk logam memiliki Eo
paling negatif sehingga tidak bisa mengalami reduksi. Memang tidak
menunjukkan perubahan yang signifikan, tetapi terbentuk
gelembung-gelembung yang belum dikenali apa jenisnya.
Sedangkan pada anode terjadi oksidasi I- menjadi I2, karena Eo yang
bernilai positif. Terbukti bahwa pada larutan di anode yang
terelektrolisis tercipta endapan berwarna kuning yang kuning itu sendiri
merupakan identitas dari iodin. Pada suhu ruangan, iodin berwujud cair.
Serta percobaan untuk membuktikan bahwa iodin benar-benar terbentuk
dilakukan pengambilan larutan dari anode dan diteteskan pada amilum,
hasilnya positif mengandung iodin karena mengubah amilum menjadi ungu
kehitam-hitaman.
2. LARUTAN Na2SO4
Dalam larutan Na2SO4 dihasilkan banyak gelembung gas pada katode dan sedikit gelembung gas pada anode. Reaksi yang terjadi adalah:
Pada katode, yang seharusnya direduksi adalah ion Na+. Karena logam Na adalah logam golongan IA yang memiliki Eo yang sangat negatif, maka yang tereduksi adalah air. Reaksi yang terjadi seperti tercantum pada reaksi di atas.
Sedangkan pada anode, juga terjadi oksidasi air karena anion larutan yang dielektrolisis merupakan anion oksi.
3. LARUTAN CuSO4
Dalam larutan CuSO4 dihasilkan endapan tembaga pada katode dan sedikit gelembung gas pada anode. Reaksi yang terjadi adalah:
Pada
katode, tidak terjadi reduksi air karena ion yang ada di katode bukan
merupakan ion dari logam golongan utama, selain itu elektrode yang
digunakan juga elektrode yang inert. Maka, yang tereduksi adalah Cu2+ sendiri.
Pada anode dihasilkan gas oksigen dan ion-ion H+ sebagai
produk dari oksidasi air. Oksidasi air terjadi karena anion pada anode
merupakan anion dari asam oksi yang tidak dapat dioksidasi.
G. KESIMPULAN :
1. Pada anode mengalami reaksi oksidasi.
2. Pada katode mengalami reaksi reduksi.
3. Reaksi reduksi oksidasi selalu terjadi bersamaan
4. Jenis elektroda mempengaruhi reaksi yang terjadi dalam sel elektrolisis.
Rabu, 05 September 2012
Cara Kirim Email via yahoo
Cara Mengirim Email atau Kirim Email dari Yahoo Bila anda baru saja membuat email di yahoo.co.id da n belum tahu bagaimana Mengirimkan Email dari Yahoo,
maka disini saya akan tunjukkan kepada anda cara mengirim email. dan
menurut saya kirim email sangatlah mudah dan semudah anda membuat email
yang baru. ok tanpa panjang lebar sekarang kita langsung aja bagaimana Cara Mengirim Email atau Kirim Email dari Yahoo. dan silahkan di simak baik2 ya...
n belum tahu bagaimana Mengirimkan Email dari Yahoo,
maka disini saya akan tunjukkan kepada anda cara mengirim email. dan
menurut saya kirim email sangatlah mudah dan semudah anda membuat email
yang baru. ok tanpa panjang lebar sekarang kita langsung aja bagaimana Cara Mengirim Email atau Kirim Email dari Yahoo. dan silahkan di simak baik2 ya...
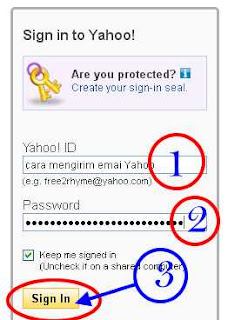
1. Memasukkan Alamat Email Yahoo email Anda
2. Masukkan Password Email Yahoo Anda dengan Benar
3. Lalu Tekan "Sign In" Untuk masuk Ke Akun yahoo Anda
Setelah anda berhasil masuk ke akun email Yahoo anda, maka akan muncul gambar seperti di bawah ini:
 Setelah masuk di akun Yahoo anda sekarang silahkan anda klik "Tulis Pesan" Untuk memulai mengirim email dari yahoo anda.
Setelah masuk di akun Yahoo anda sekarang silahkan anda klik "Tulis Pesan" Untuk memulai mengirim email dari yahoo anda.
Setelah anda klik Tulis pesan maka akan muncul gambar seperti berikut:
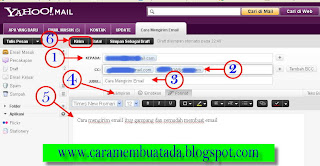 Ket.
Ket.
1. Kepada : Isikan alamat Email Tujuan .
3. Judul : Isikan Judul Email Anda. ( Dikosongi juga boleh ) tapi alangkah baiknya di isi saja, agar tidak di anggap sebagai SPAM
4. Lampiran : Anda juga bisa mengirimkan (menambahkan File ) lewat email ini dengan Format: Doc, pdf, Rar, Zip, Mp3, dan sebagainya, dengan catatan File tidak melebihi dari 10 Mega.
5. Isi surat/Email : Silahkan tulis Surat / Email Anda di situ… seperti anda mengetik di
Microsoftword.
6. Tombol Kirim : Setelah selesai menulis suratnya, sekarang Anda tinggal mengirimnya yaitu
dengan cara “KLIK” Tombol “Kirim” dan Tunggu beberapa saat sampai muncul gambar seperti di bawah ini:
 n belum tahu bagaimana Mengirimkan Email dari Yahoo,
maka disini saya akan tunjukkan kepada anda cara mengirim email. dan
menurut saya kirim email sangatlah mudah dan semudah anda membuat email
yang baru. ok tanpa panjang lebar sekarang kita langsung aja bagaimana Cara Mengirim Email atau Kirim Email dari Yahoo. dan silahkan di simak baik2 ya...
n belum tahu bagaimana Mengirimkan Email dari Yahoo,
maka disini saya akan tunjukkan kepada anda cara mengirim email. dan
menurut saya kirim email sangatlah mudah dan semudah anda membuat email
yang baru. ok tanpa panjang lebar sekarang kita langsung aja bagaimana Cara Mengirim Email atau Kirim Email dari Yahoo. dan silahkan di simak baik2 ya...
Pertama silahkan Login dahulu di akun email Yahoo Anda dengan memasukkan alamat www.yahoomail.com , setelah anda memasukkan alamat tersebut maka akan muncul kendela baru seperti di bawah ini:

1. Memasukkan Alamat Email Yahoo email Anda
2. Masukkan Password Email Yahoo Anda dengan Benar
3. Lalu Tekan "Sign In" Untuk masuk Ke Akun yahoo Anda
Setelah anda berhasil masuk ke akun email Yahoo anda, maka akan muncul gambar seperti di bawah ini:
 Setelah masuk di akun Yahoo anda sekarang silahkan anda klik "Tulis Pesan" Untuk memulai mengirim email dari yahoo anda.
Setelah masuk di akun Yahoo anda sekarang silahkan anda klik "Tulis Pesan" Untuk memulai mengirim email dari yahoo anda.Setelah anda klik Tulis pesan maka akan muncul gambar seperti berikut:
 Ket.
Ket.1. Kepada : Isikan alamat Email Tujuan .
2. Cc : “Copy Carbon”
maksudnya adalah anda bisa mengirimkan dengan beberapa alamat email
sekaligus. Bila anda hanya mengirim email dengan 1 alamat saja
maka, maka Dikosongkan saja.
maka, maka Dikosongkan saja.
3. Judul : Isikan Judul Email Anda. ( Dikosongi juga boleh ) tapi alangkah baiknya di isi saja, agar tidak di anggap sebagai SPAM
4. Lampiran : Anda juga bisa mengirimkan (menambahkan File ) lewat email ini dengan Format: Doc, pdf, Rar, Zip, Mp3, dan sebagainya, dengan catatan File tidak melebihi dari 10 Mega.
5. Isi surat/Email : Silahkan tulis Surat / Email Anda di situ… seperti anda mengetik di
Microsoftword.
6. Tombol Kirim : Setelah selesai menulis suratnya, sekarang Anda tinggal mengirimnya yaitu
dengan cara “KLIK” Tombol “Kirim” dan Tunggu beberapa saat sampai muncul gambar seperti di bawah ini:
Bila muncul gambar seperti di atas Berarti anda sudah berhasil mengirimkan email dari yahoo. Setelah itu Anda Klik "Selesai" untuk kembali ke menu awal. dan sekarangpun anda sudah tahu Cara mengirim email atau Kirim Email dari Yahoo ?? Semoga manfaat.
Langganan:
Postingan (Atom)









