Pendahuluan
Dalam
sel volta, reasi redoks spontan digunakan sebagai sumber arus listrik.
Sel elektrolisis merupakan kebalikan dari sel volta. Dalam sel
elektrolisis, listrik digunakan untuk melangsungkan reaksi redoks yang
tidak spontan.
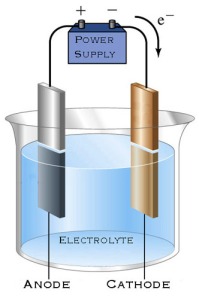
sel elektrolisis
Sel
elektrolisis terdiri dari sebuah wadah, elektroda, elektrolit, dan
sumber arus searah. Elektron memasuki kutub negatif (katoda). Spesi
tertentu dalam larutan menyerap elektron dari katoda dan mengalami
reduksi. Sementara itu, spesi lain akan melepas elektron di anoda dan
mengalami oksidasi. Jadi sama seperti pada sel volta, reaksi di katoda
adalah reduksi, dan reaksi di anoda adalah oksidasi. Akan tetapi muatan
elektrodanya berbeda. Pada sel volta, katoda bermuatan positif, dan
anoda bermuatan negatif. Pada sel elektrolisis, katoda bermuatan negatif
dan anoda bermuatan positif.
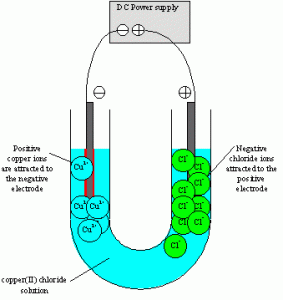
sel elektrolisis menggunakan tabung U
B. Alat dan Bahan
Alat
- Tabung U
- Batang Karbon
- Sumber arus listrik
- Kabel
- Pipet tetes
Bahan
- Larutan elektrolit
- Indikator asam basa
C. Prosedur Kerja
- Rangkailah sebuah sel elektrolisis
- Tambahkan 10 tetes indikator phenophtalein ke dalam kira-kira 50 mL larutan sampel
- Lakukan elektrolisis hingga terjadi perubahan warna di kedua elektroda











Tidak ada komentar:
Posting Komentar